프랑크푸르트 괴테대학교에서 실시한 연구에서는 탈리도마이드 유도체가 암 치료에 잠재적으로 적합할 가능성이 있음을 지적합니다. 1950년대에는 탈리도마이드가 수면제로 판매되었습니다. 나중에는 임신 초기에 태아에게 심각한 기형을 일으키는 것으로 악명이 높아졌습니다.
이 분자는 또한 세포 내 단백질의 파괴를 표시하는 것으로 알려져 있습니다. 현재 연구의 일환으로 과학자들은 탈리도마이드 유도체를 만들었습니다. 그들은 이 물질들이 암세포의 생존을 담당하는 단백질의 파괴에 영향을 미친다는 것을 보여줄 수 있었습니다.
아마도 탈리도마이드만큼 파란만장한 과거를 지닌 분자는 없을 것입니다. 이는 1950년대에 많은 국가에서 진정-수면제로 승인된 약물의 주요 성분이었습니다. 그러나 탈리도마이드를 복용한 임산부가 심각한 기형을 가진 아이를 낳는 경우가 많다는 사실이 곧 명백해졌습니다.
그러나 최근 수십 년 동안 의학은 이에 다시 큰 기대를 걸었습니다. 연구에 따르면 무엇보다도 혈관의 성장을 억제하므로 영양 배지에서 종양을 차단하는 데 잠재적으로 적합하다는 것이 밝혀졌습니다. 그러다가 골수에 발생하는 악성 종양인 다발성 골수종 치료에도 매우 효과적인 것으로 입증되었습니다.
“이제 우리는 탈리도마이드가 '분자 접착제'라고 불릴 수 있다는 사실을 알고 있습니다."라고 프랑크푸르트 괴테 대학교 제약 화학 연구소의 Xinglai Cheng 박사는 설명합니다. "이것은 두 개의 단백질을 잡아서 결합할 수 있다는 것을 의미합니다."
이 단백질 중 하나가 일종의 "라벨링 기계"이기 때문에 이는 특히 흥미롭습니다. 이는 다른 단백질에 명확한 "TRASH" 라벨을 부착합니다.
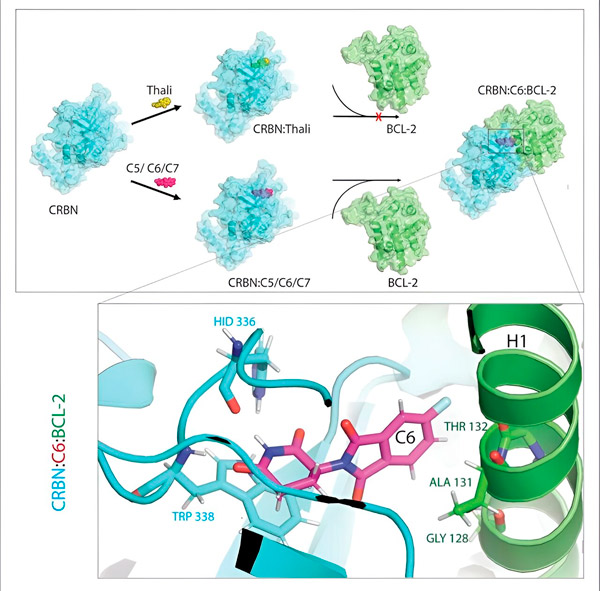
탈리도마이드 유도체 C5, C6 및 C7은 "표지 기계"인 CRBN을 변형하여 BCL-2에 결합할 수 있습니다. 따라서 BCL-2 분자는 분해된 것으로 표시되며 이는 암과 싸우기 위한 가능한 새로운 전략입니다. 저자: 싱라이 쳉 박사
세포의 폐기물 처리 시스템은 이 태그를 인식합니다. 즉, 레이블이 붙은 단백질 분자를 잡아서 잘게 찢습니다. "이 메커니즘이 탈리도마이드의 다양한 효과를 설명합니다."라고 청은 말합니다. "어떤 단백질이 태그로 표시되었는지에 따라 배아 발달 중에 기형이 생기거나 악성 세포가 파괴될 수 있습니다."
이 메커니즘은 암세포가 생존하기 위해 특정 단백질에 의존하기 때문에 큰 의학적 희망을 제공합니다. 체계적으로 표적을 지정하고 잘게 찢을 수 있다면 질병을 치료할 수 있습니다. 문제는 분자 접착제가 매우 독특하다는 것입니다.
결합 파트너 중 하나는 항상 세포 표시 기계 또는 과학 용어로 CRBN이라고 하는 E3 리가제입니다. 신체의 수천 개 단백질 중에서 두 번째 파트너가 될 수 있는 단백질은 극소수에 불과합니다. 어떤 단백질이 접착제에 의존하는지요.
"그래서 우리는 일련의 탈리도마이드 유도체를 만들었습니다."라고 청은 말합니다. "그런 다음 접착 특성이 있는지, 그렇다면 어떤 단백질에 효과적인지 조사했습니다." 이를 위해 연구자들은 성장한 세포 계통의 모든 단백질에 유도체를 첨가했습니다. 그런 다음 CRBN이 있을 때 이러한 단백질 중 어느 것이 분해되는지 관찰했습니다.
"이 과정에서 우리는 분해에 매우 중요한 세포 단백질인 BCL-2를 태그할 수 있는 세 가지 유도체를 확인했습니다."라고 Cheng은 설명합니다. "BCL-2는 세포가 자체 파괴 프로그램을 활성화하는 것을 막습니다. 따라서 BCL-2가 없으면 세포가 죽습니다."
따라서 BCL-2는 오랫동안 암 연구의 초점이었습니다. 백혈병 치료제인 베네토클렉스도 이미 있는데, 이 약물은 BCL-2의 효과를 감소시켜 돌연변이된 세포가 자체 파괴되도록 합니다.
"그러나 많은 암 세포에서 BCL-2 자체가 돌연변이됩니다. 그 결과 베네토클렉스는 더 이상 단백질을 억제하지 않습니다."라고 Cheng은 말합니다. "저희는 저희 유도체가 이 돌연변이 형태를 분해를 위해 표시한다는 것을 보여줄 수 있었습니다. 게다가, Max Planck Institute for Biophysics의 저희 파트너들은 컴퓨터에서 탈리도마이드 유도체와 BCL-2의 상호작용을 시뮬레이션했습니다. 이를 통해 유도체가 베네토클락스와 완전히 다른 부위에 결합한다는 것을 보여주었습니다. 이 결과는 나중에 실험적으로도 확인할 수 있었습니다."
게다가, 연구자들은 암세포가 있는 과일파리에서 그들의 물질을 테스트했습니다. 이런 방식으로 처리한 파리의 생존율은 상당히 높았습니다. 하지만, Cheng은 이러한 결과가 아직 기초 연구이기 때문에 너무 흥분하지 않도록 경고합니다. "그들은 변형된 탈리도마이드 분자가 큰 치료적 잠재력을 가지고 있음을 보여주지만, 그것이 어느 시점에서 실제로 입증될지는 아직 말할 수 없습니다."
연구 결과는 저널 Cell Reports Physical Science에 게재되었습니다.

