신경과 산하 신경종양학 Ken 및 Ruth Davey 부서 교수인 Shi-Yuan Cheng 박사 연구실에서 수행한 연구에서는 신경교종 종양 세포에서 대체 RNA 스플라이싱 현상의 기초가 되는 새로운 메커니즘을 확인했습니다. 새로운 치료 목표. 연구 결과는 Journal of Clinical Investigation에 게재되었습니다.
"우리는 대체 접합이라는 렌즈를 통해 신경교종을 치료하는 다른 방법을 찾았으며 이전에는 확인되지 않았지만 신경교종 악성 종양에 중요한 새로운 표적을 발견했습니다." 신경학 부교수이자 이번 연구의 주저자인 Xiao Song 박사는 말했습니다.
신경교종은 성인에게 가장 흔한 유형의 원발성 뇌종양으로 중추신경계에서 발견되고 인근 뉴런을 지원하는 신경교세포에서 발생합니다. 신경교종은 종양의 유전적, 후생적 이질성으로 인해 방사선 및 화학요법을 포함한 표준 치료에 대한 내성이 매우 높으며, 이는 새로운 치료 표적을 찾는 필요성을 강조합니다.
Cancer Research에 발표된 Cheng 연구소의 이전 연구에서는 중요한 스플라이싱 인자인 SRSF3가 정상 뇌에 비해 신경교종에서 상당히 증가하고 SRSF3에 의해 조절되는 것으로 나타났습니다. RNA 스플라이싱은 종양 세포의 여러 세포 과정에 영향을 주어 신경교종의 성장과 진행을 촉진합니다.
RNA 스플라이싱은 인트론(RNA의 비암호화 영역)을 제거하고 엑손(암호화 영역)을 결합하여 세포에서 유전자 발현을 지원하는 성숙한 mRNA 분자를 형성하는 과정입니다.
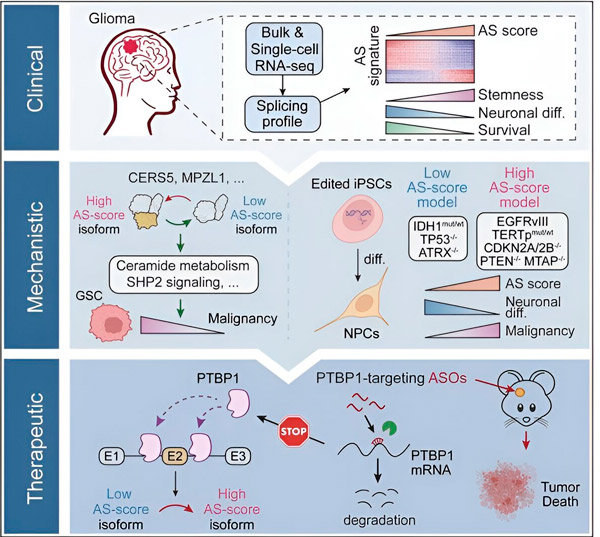
현재 연구에서 과학자들은 신경아교종 종양 세포의 대체 접합의 변화와 이러한 변화의 기본 메커니즘을 확인하고 치료 표적으로서의 잠재력을 결정하기 시작했습니다.
컴퓨터 방법과 RNA 염기서열 분석 기술을 사용하여 연구진은 환자 샘플에서 신경아교종 종양 세포의 스플라이싱 변형을 조사했습니다. 이러한 변화를 확인하기 위해 그들은 CRISPR 유전자 편집 기술을 사용하여 인간 유도 만능 줄기세포(iPSC) 유래 신경교종 모델에 다양한 신경교종 유발 돌연변이를 도입했습니다.
그들은 이러한 스플라이싱 변화가 신경교종을 포함한 많은 종양에서 과발현되고 IDH1 유전자의 돌연변이에 의해 억제되는 것으로 알려진 표피 성장 인자 수용체 III(EGFRIII)의 변종에 의해 강화된다는 것을 발견했습니다. 피>
연구원들은 서로 다른 아미노산 서열을 갖는 서로 다른 단백질 동형체를 생성하는 두 가지 RNA 스플라이싱 이벤트의 기능을 확인했습니다.
"정상 뇌에서 일반적으로 발현되는 다른 이소형과 달리 이들 이소형 중 하나만 종양 성장을 촉진할 수 있습니다. 종양은 이 메커니즘을 사용하여 정상적인 뇌 이소형에 비해 종양 촉진 이소형을 선택적으로 발현합니다." 말했다.
다음으로 팀은 상류 RNA 결합 단백질을 분석하여 PTBP1 유전자가 신경교종 세포에서 종양 촉진 RNA 스플라이싱을 조절한다는 사실을 발견했습니다. 연구진은 신경교종의 동소성 면역결핍 마우스 모델을 사용하여 안티센스 올리고뉴클레오티드(ASO) 요법으로 PTBP1을 표적으로 삼았으며 이는 궁극적으로 종양 성장을 억제했습니다.
"우리의 데이터는 신경교종 악성종양과 이질성에 영향을 미치는 대체 RNA 스플라이싱의 역할과 성인 신경교종 치료에 대한 치료 취약성으로서의 잠재력을 강조합니다."라고 연구 저자는 썼습니다.
다음 연구원들은 항종양 면역 반응을 유도하기 위해 PTBP1을 표적으로 삼는 가능성을 탐구할 계획이라고 송씨는 말했습니다.
"장기 판독 RNA-seq 분석을 사용하여 우리는 신경교종 세포에서 PTBP1을 표적으로 삼으면 정상 조직에는 없는 대체적으로 접합된 전사체가 많이 생성된다는 사실을 발견했습니다. 따라서 우리의 다음 프로젝트는 이 동형체가 일부 항원을 생성합니다." 그래야 면역체계가 종양을 더 잘 인식할 수 있다”고 송씨는 말했다.
송 교수는 또한 그녀의 팀이 면역세포와 같은 신경교종 환자의 비종양 세포의 스플라이싱 변화를 분석하는 데 관심이 있다고 덧붙였습니다.
"우리는 스플라이싱이 세포의 기능을 조절하는 데 매우 중요하다는 것을 이미 알고 있으므로 종양 악성 종양을 조절할 뿐만 아니라 면역 세포의 기능을 조절하여 암을 효과적으로 죽일 수 있는지 여부를 결정할 수도 있습니다. 그래서 우리는 또한 면역 세포가 종양에 침투한 후 스플라이싱에 변화가 있는지 알아보기 위해 종양에 침투한 면역 세포에 대한 생물정보학 분석을 수행합니다.
"우리의 목표는 면역 억제 종양 미세 환경을 형성하는 데 있어서 대체 접합의 역할을 결정하고 신경교종에서 면역 요법의 효과를 향상시킬 수 있는 잠재적 표적을 식별하는 것입니다."라고 송 교수는 말했습니다.

