기사의 의료 전문가
새로운 간행물
인간 면역 결핍 바이러스(HIV)
최근 리뷰 : 04.07.2025
후천성 면역결핍 증후군은 1981년 미국에서 특정 질병으로 확인되었습니다. 당시 많은 젊은이들이 건강한 사람에게는 병원성이 없거나 약하게 작용하는 미생물에 의해 심각한 질병을 앓았습니다. 환자의 면역 상태를 조사한 결과, 림프구, 특히 T-헬퍼 림프구 수가 급격히 감소하는 것으로 나타났습니다. 이 질환은 AIDS(후천성 면역결핍 증후군)라고 불렸습니다. 감염 경로(성적 접촉, 혈액 및 혈액 제제)는 이 질병의 전염성을 시사했습니다.
AIDS의 원인균은 1983년 프랑스인 L. 몽타니에가 독자적으로 발견했는데, 그는 림프절 종대 환자에게서 이 바이러스를 발견했기 때문에 LAV 림프절종대 관련 바이러스라는 이름을 붙였습니다. 그리고 미국인 R. 갈로는 이 바이러스를 HTLV-III(인간 T-림프친화성 바이러스 III)라고 명명했습니다. 그는 이전에 림프친화성 바이러스 I과 II를 발견한 바 있습니다.
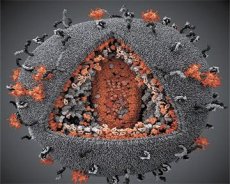
LAV와 HTLV-III 바이러스의 특성을 비교한 결과 두 바이러스의 동일성이 확인되어 혼동을 피하기 위해 1986년에 HIV(인간 면역 결핍 바이러스 또는 HIV)라는 이름이 붙여졌습니다. HIV는 구형이며 지름이 110nm입니다. 바이러스 외피는 12개의 오각형과 20개의 육각형으로 구성된 다면체 모양입니다. 각 육각형의 중앙과 모서리에는 당화된 단백질 gpl20(숫자 120은 단백질의 분자량을 킬로달톤으로 나타냄) 분자가 있습니다. 총 72개의 gpl20 분자가 바이러스 입자 표면에 특이한 스파이크 형태로 위치하고 있으며 각각은 막 내 단백질 gp41과 연결되어 있습니다. 이러한 단백질은 이중 지질층과 함께 바이러스 입자의 슈퍼캡시드(막)를 형성합니다.
Gpl20과 gp41 단백질은 세포 내 프로테아제에 의해 Env 전구체 단백질이 절단되어 형성됩니다. gp41 단백질은 세포질 도메인과 외피 바로 아래에 위치한 기질 단백질 p17MA에 결합하여 스파이크 "줄기"를 형성합니다. p17 분자는 바이러스 입자 성숙 과정에서 상호 작용하여 외피 아래에 정이십면체를 형성합니다.
비리온의 중앙 부분에서 p24 단백질은 원뿔 모양의 캡시드를 형성합니다. 캡시드의 좁은 부분은 rb 단백질의 작용으로 비리온 막에 연결됩니다. 캡시드 내부에는 두 개의 동일한 바이러스 게놈 RNA 분자가 있습니다. 이 분자들은 5' 말단을 통해 뉴클레오캡시드 단백질 p7NC에 연결되어 있습니다. 이 단백질은 시스테인과 히스티딘이 풍부하고 아연 원자를 포함하는 두 개의 아미노산 잔기(모티프)를 가지고 있어 흥미롭습니다. 이 모티프는 게놈 RNA 분자를 포획하여 비리온 형성에 포함시키기 때문에 "아연 손가락"이라고 불립니다. 캡시드에는 또한 세 가지 효소가 포함되어 있습니다. 역전사효소(RT) 또는 폴 복합체는 역전사효소, RNase H, 그리고 DNA 의존성 DNA 중합효소를 포함합니다. 역전사효소는 이종이합체 p66/p51로 존재합니다. 프로테아제(PR)인 p10은 비리온 성숙 과정을 시작하고 실행합니다. 인테그레이스(IN) - p31 또는 엔도뉴클레아제는 프로바이러스 DNA를 숙주 세포 유전체에 삽입하는 역할을 합니다. 캡시드에는 프라이머 RNA(tRNA-1) 분자도 포함되어 있습니다.
세포 내 RNA 유전체는 역전사효소의 도움을 받아 9,283개의 뉴클레오타이드 쌍으로 구성된 DNA 유전체(DNA 프로바이러스)로 변환됩니다. 이 유전체는 좌우로 긴 말단 반복 서열(LTR)에 의해 둘러싸여 있는데, 왼쪽은 5'-LTR, 오른쪽은 3'-LTR입니다. LTR은 각각 638개의 뉴클레오타이드 쌍으로 구성되어 있습니다.
HIV 유전체는 9개의 유전자로 구성되어 있으며, 그중 일부는 말단이 서로 겹치며(여러 개의 판독 프레임을 가짐) 엑소닌트론 구조를 가지고 있습니다. 이 유전자들은 9개의 구조 단백질과 6개의 조절 단백질의 합성을 조절합니다.
바이러스 게놈에 대한 LTR의 중요성은 다음과 같은 기능을 제어하는 조절 요소를 포함하고 있다는 점입니다.
- 전사 신호(프로모터 영역)
- 폴리-A 첨가 신호;
- 캡핑 신호;
- 통합 신호;
- 양성 조절 신호(TAT 단백질에 대한 TAR)
- 음성 조절 요소(NEF 단백질의 경우 NRE)
- 3' 말단에서 마이너스 스트랜드 DNA 합성을 위한 프라이머 RNA(tRNA™3)가 부착되는 부위; 플러스 스트랜드 DNA 합성을 위한 프라이머 역할을 하는 LTR의 5' 말단의 신호.
또한, LTR은 mRNA 스플라이싱, 즉 vRNA 분자를 캡시드로 패키징하는 과정(Psi 요소)을 조절하는 요소들을 포함합니다. 마지막으로, 유전체 전사 과정에서 REV 단백질의 긴 mRNA에서 두 가지 신호가 생성되는데, 이는 단백질 합성을 전환합니다. CAR은 조절 단백질을, CRS는 구조 단백질을 조절합니다. REV 단백질이 CAR에 결합하면 구조 단백질이 합성되고, 결합하지 않으면 조절 단백질만 합성됩니다.
다음의 조절 유전자와 단백질은 바이러스 게놈의 기능을 조절하는 데 특히 중요한 역할을 합니다.
- 바이러스 복제의 긍정적 조절을 수행하고 TAR 조절 영역을 통해 작용하는 TAT 단백질.
- NRE 영역을 통해 복제의 음성적 제어를 행사하는 NEV 및 VPU 단백질
- 양성-음성 조절을 담당하는 REV 단백질. REV 단백질은 gag, pol, env 유전자의 작용을 조절하고 스플라이싱의 음성 조절을 담당합니다.
따라서 HIV 복제는 양성, 음성, 양성-음성의 세 가지 조절을 받습니다.
VIF 단백질은 새로 합성된 바이러스의 감염성을 결정합니다. VIF 단백질은 p24 캡시드 단백질과 결합되어 있으며, 바이러스 입자 내에 60개 분자로 존재합니다. NEF 단백질은 바이러스 입자 내에 소수의 분자(5~10개)로 존재하며, 외피와 결합되어 있을 가능성이 있습니다.
VPR 단백질은 G2기에서 세포 주기를 억제하고, 사전 통합 복합체의 세포핵 내 수송에 관여하며, 일부 바이러스 및 세포 유전자를 활성화하고, 단핵구와 대식세포에서 바이러스 복제 효율을 증가시킵니다. 비리온 내 VPR, TAT, REV, VPU 단백질의 위치는 아직 밝혀지지 않았습니다.
바이러스막은 자체 단백질 외에도 숙주 세포의 단백질을 함유할 수 있습니다. VPU와 VPR 단백질은 바이러스의 번식 조절에 관여합니다.
인간 면역 결핍 바이러스(HIV)의 항원 변이
인간 면역결핍 바이러스(HIV)는 매우 가변적입니다. 한 환자의 체내에서도 항원성이 크게 다른 바이러스 균주가 분리될 수 있습니다. 이러한 가변성은 CD4+ 세포의 집중적인 파괴와 HIV 감염에 대한 강력한 항체 반응에 의해 촉진됩니다. 생물학적으로는 HIV-1과 유사하지만 면역학적으로는 다른 새로운 형태의 HIV인 HIV-2가 서아프리카 환자에서 분리되었습니다. 이 바이러스들의 유전체 1차 구조 상동성은 42%입니다. DNA 프로바이러스 HIV-2는 9,671 bp, LTR은 854 bp입니다. 이후 HIV-2는 세계 다른 지역에서도 분리되었습니다. HIV-1과 HIV-2 사이에는 교차 면역이 없습니다. HIV-1은 O(Outlier)와 M(Major)의 두 가지 주요 형태로 알려져 있으며, M은 10개의 아형(AJ)으로 나뉩니다. 러시아에는 8개의 아형(AH)이 존재합니다.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
HIV와 세포 간의 상호작용 메커니즘
바이러스는 체내에 침투하면 먼저 자신에게 특이적인 CD4 수용체를 가진 세포를 공격합니다. 이 수용체는 T-헬퍼 세포에 다량 존재하고, 대식세포와 단핵구에는 소량 존재하며, T-헬퍼 세포는 바이러스에 특히 민감합니다.
인간 면역결핍 바이러스(HIV)는 gpl20 단백질을 이용하여 CD4 수용체를 인식합니다. HIV가 세포와 상호작용하는 과정은 다음과 같은 순서로 진행됩니다. 수용체 매개 흡착 -> 코팅된 구멍 -> 코팅된 소포 -> 리소좀. 리소좀 내에서 바이러스 입자 막이 리소좀 막과 융합하고, 슈퍼캡시드에서 분리된 뉴클레오캡시드가 세포질로 들어갑니다. 핵으로 이동하는 과정에서 뉴클레오캡시드가 파괴되면서 유전체 RNA와 관련 핵심 구성 요소가 방출됩니다. 그 후, 역전사효소가 바이러스 입자 RNA의 (-) 가닥 DNA를 합성하고, RNase H가 바이러스 입자 RNA를 파괴합니다. 그리고 바이러스 DNA 중합효소가 DNA의 (-) 가닥 DNA를 합성합니다. DNA 프로바이러스의 말단에는 5'-LTR과 3'-LTR이 형성됩니다. DNA 프로바이러스는 핵 안에 잠시 동안 비활성 상태로 남아 있을 수 있지만, 조만간 인테그라제의 도움을 받아 표적 세포의 염색체에 통합됩니다. 이 인테그라제 안에서 프로바이러스는 주어진 T 림프구가 미생물 항원이나 다른 면역 세포에 의해 활성화될 때까지 비활성 상태를 유지합니다. 세포 DNA 전사의 활성화는 특수 핵인자(NF-kB)에 의해 조절됩니다. 이 단백질은 DNA 결합 단백질이며 T 림프구와 단핵구의 활성화 및 증식 과정에서 대량으로 생성됩니다. 이 단백질은 특정 세포 DNA 서열 및 DNA 프로바이러스의 유사한 LTR 서열에 결합하여 세포 DNA와 DNA 프로바이러스의 전사를 유도합니다. DNA 프로바이러스의 전사를 유도함으로써 바이러스는 비활성 상태에서 활성 상태로, 즉 지속적인 감염 상태에서 생산적인 감염 상태로 전환됩니다. 프로바이러스는 매우 오랫동안 비활성 상태를 유지할 수 있습니다. 바이러스의 활성화는 세포와의 상호작용에 있어 중요한 순간입니다.
바이러스가 세포에 침투하는 순간부터 HIV 감염 기간이 시작됩니다. 이 기간은 10년 이상 지속될 수 있는 바이러스 보균자 상태가 됩니다. 그리고 바이러스가 활성화되는 순간부터 질병이 시작됩니다. AIDS입니다. 조절 유전자와 그 산물의 도움으로 바이러스는 활발하게 증식하기 시작합니다. TAT 단백질은 바이러스 증식 속도를 1,000배까지 증가시킬 수 있습니다. 바이러스 전사는 복잡합니다. 전장 mRNA와 아유전체 mRNA의 형성, mRNA 스플라이싱, 그리고 구조 단백질과 조절 단백질의 합성이 포함됩니다.
구조 단백질의 합성은 다음과 같이 일어납니다.먼저, Pr55Gag 전구체 폴리단백질(분자량이 55kDa인 단백질)이 합성됩니다.이것은 4개의 주요 도메인을 포함합니다: 매트릭스(MA), 캡시드(CA), 뉴클레오캡시드(NC), rb 도메인.바이러스 프로테아제에 의해 Pr55Gag가 절단된 결과(다른 전구체 단백질인 Gag-Pol에서 자가 절단됨) 구조 단백질 p17, p24, p7, rb가 각각 형성됩니다.Pr55Gag 폴리단백질의 형성은 바이러스 입자 형성의 주요 조건입니다.이 단백질은 바이러스 입자 형태 형성 프로그램을 결정합니다.그것은 Gag 폴리단백질을 세포막으로 운반하는 단계, 이와의 상호작용, 바이러스 입자 형성 및 출아 동안의 단백질-단백질 상호작용을 순차적으로 포함합니다.Pr55Gag는 자유 폴리리보솜에서 합성됩니다. 단백질 분자는 소수성 영역에 의해 고정된 막으로 운반됩니다. CA 도메인은 Gag 단백질의 고유 형태를 만드는 데 중요한 역할을 합니다. NC 도메인은 ("아연 손가락"의 도움으로) 형성되는 바이러스 입자의 구성에 두 분자의 게놈 RNA가 포함되도록 합니다. 폴리단백질 분자는 처음에는 매트릭스 도메인의 상호작용으로 인해 이합체화됩니다. 그 후, 이합체들은 CA 도메인과 NC 도메인의 상호작용으로 6개 단위로 구성된 6합체 복합체로 결합합니다. 마지막으로, 측면 표면에서 결합된 6합체들은 미성숙 구형 비리온을 형성하고, 그 안에 게놈 바이러스 RNA가 담겨 NC 도메인에 의해 포획됩니다.
또 다른 전구체 단백질인 Prl60Gag-Pol(분자량 160 kDa 단백질)은 rb 단백질을 암호화하는 영역의 바로 상류에 위치한 gag 유전자의 3'-말단이 번역되는 동안 리보솜에 의한 프레임시프트(frameshift)의 결과로 합성됩니다. 이 Gag-Pol 폴리단백질은 불완전한 Gag 단백질 서열(1~423개 아미노산)과 PR, RT, IN 도메인을 포함하는 Pol 서열을 포함합니다. Gag-Pol 폴리단백질 분자는 유리 폴리리보솜에서도 합성되어 세포막으로 운반됩니다. Prl60Gagpol 폴리단백질은 Gag 폴리단백질에 내재된 모든 분자 간 상호작용 부위와 막 결합 부위를 포함합니다. 따라서 Gag-Pol 폴리단백질 분자는 막과 융합하고, Gag 분자와 함께 형성되는 비리온에 포함되어 활성 프로테아제가 나타나고 비리온 성숙 과정이 시작됩니다. HIV-1 프로테아제는 이합체 형태로만 높은 활성을 나타내므로, Prl60Gag-Pol로부터 자가 절제하려면 이 분자들의 이합체화가 필요합니다. 비리온 성숙은 방출된 활성 프로테아제가 자신이 인식하는 부위에서 prl60Gag-Pol과 Gag55를 절단하는 과정으로 이루어집니다. 이때 단백질 p17, p24, p7, p6, 역전효소, 인테그라제가 형성되고 바이러스 구조에 결합하게 됩니다.
Env 단백질은 소포체 막과 연결된 리보솜에서 합성된 후, 당화되고 세포질 단백질 분해효소에 의해 gp120과 gp41로 절단되어 세포 표면으로 운반됩니다. 이 경우, gp41은 막을 관통하여 막 안쪽 표면과 연결된 Gag 단백질 분자의 기질 도메인에 결합합니다. 이러한 결합은 성숙한 비리온에서도 유지됩니다.
따라서 바이러스 입자의 조립은 숙주 세포의 세포막에서 전구체 단백질과 관련 RNA 분자의 응집, 미성숙 비리온의 형성, 그리고 출아를 통한 세포 표면의 방출로 구성됩니다. 출아 과정에서 비리온은 gp41과 gp120 분자가 박혀 있는 세포막으로 자신을 둘러쌉니다. 출아 과정 중 또는 비리온 방출 후, 바이러스 단백질 분해효소의 도움으로 성숙이 진행되며, 이는 전구체 단백질인 Pr55Gag와 Prl60Gag-Pol을 단백질 분해에 의해 성숙 바이러스 단백질로 절단하고 특정 구조적 복합체를 형성하는 과정으로 구성됩니다. 바이러스 형태형성 과정에서 주도적인 역할을 하는 것은 미성숙 비리온을 조직하고 조립하는 전구체 다단백질인 Pr55Gag입니다. 성숙 과정은 특정 바이러스 단백질 분해효소에 의해 완료됩니다.
면역결핍의 원인
HIV 감염 시 면역결핍의 주요 원인 중 하나는 T-헬퍼의 대량 사멸입니다. 이는 다음과 같은 원인으로 발생합니다. 첫째, 바이러스에 감염된 T-헬퍼는 세포자멸사로 인해 사멸합니다. AIDS 환자의 경우 바이러스 복제, 세포자멸사, 그리고 T-헬퍼의 수 감소가 서로 연관되어 있는 것으로 알려져 있습니다. 둘째, T-킬러는 바이러스에 감염되었거나 gpl20 분자를 흡착한 T 세포, 그리고 바이러스 감염 여부와 관계없이 수십 개의 세포로 구성된 세포융합체(싱사이튬)를 형성하는 T-헬퍼를 인식하고 파괴합니다. (이 중 일부는 바이러스 증식으로 인해 사멸합니다.) 다수의 T-헬퍼가 파괴됨에 따라 B 림프구의 막 수용체에서 인터루킨-2의 발현이 감소하고, 다양한 인터루킨(성장 인자 및 B 림프구 분화 - IL-4, IL-5, IL-6 등)의 합성이 저해되어 T-킬러 시스템의 기능이 저하됩니다. 보체 및 대식세포 시스템의 활동이 억제됩니다. 바이러스에 감염된 대식세포와 단핵구는 오랫동안 사멸하지 않지만, 체내에서 바이러스를 제거할 수 없습니다. 마지막으로, gpl20은 신체의 일부 상피 세포 수용체(HIV의 이식 전파를 매개하는 영양막 수용체 포함)와 구조적 및 항원적 유사성을 가지고 있어 광범위한 작용을 하는 항수용체 항체가 합성됩니다. 이러한 항체는 다양한 세포 수용체를 차단하여 자가면역 질환의 진행을 복잡하게 만들 수 있습니다. HIV 감염의 결과는 면역 체계의 모든 주요 연결 고리가 파괴되는 것입니다. 이러한 환자는 다양한 미생물에 대해 무방비 상태가 됩니다. 이는 기회 감염과 종양 발생으로 이어집니다. HIV 감염 환자의 경우, 카포시 육종, 피부암을 포함한 암종, 그리고 B 림프구의 악성 변형으로 발생하는 B 세포 림프종 등 최소 세 가지 유형의 암 발생 위험이 증가합니다. 그러나 HIV는 림프구친화성뿐만 아니라 신경친화성도 가지고 있습니다. HIV는 수용체 매개 세포내이입(endocytosis)과 성상세포에 의한 바이러스 감염 림프모세포의 식세포작용을 통해 중추신경계 세포(성상세포)로 침투합니다. 바이러스가 성상세포와 상호작용하면 심플라스트가 형성되어 세포 간 통로를 통해 병원균이 확산되는 것을 촉진합니다. 바이러스는 대식세포와 단핵구에 오랫동안 생존할 수 있으므로, 체내에서 바이러스의 저장고이자 분배기 역할을 하며 모든 조직에 침투할 수 있습니다. 감염된 대식세포는 HIV가 중추신경계에 유입되어 손상되는 데 중요한 역할을 합니다. 환자의 10%에서 주요 임상 증후군은 중추신경계 손상과 관련이 있으며 치매로 나타납니다. 따라서 HIV 감염자는 기회감염,종양 질환 및 중추 신경계 손상.
HIV 감염의 역학
HIV 감염의 원인은 오직 사람, 즉 환자나 바이러스 보균자뿐입니다. 인간면역결핍바이러스(HIV)는 혈액, 정액, 자궁경부액에, 수유부의 경우 모유에 존재합니다. 감염은 성행위, 혈액 및 그 조제품을 통해, 그리고 출산 전, 출산 중, 출산 후 산모에서 아이에게로 전파될 수 있습니다. 음식, 음료, 곤충 물림을 통한 감염 사례는 아직 알려지지 않았습니다.
약물 중독은 에이즈 확산에 기여합니다. HIV 발병률은 매년 증가하고 있습니다. 세계보건기구(WHO)에 따르면 1980년부터 2000년까지 5,800만 명이 HIV에 감염되었습니다. 2000년 한 해에만 전 세계적으로 530만 명이 감염되었고, 300만 명이 에이즈로 사망했습니다. 2004년 1월 1일 기준, 러시아에는 26만 4천 명의 HIV 감염자가 등록되어 있습니다. HIV 감염자의 절반은 감염 후 11~12년 이내에 사망합니다. 2004년 초 러시아 국민 10만 명 중 약 180명이 "HIV 감염" 진단을 받았습니다. 이러한 수준의 유병률로 볼 때, 2012년까지 러시아의 HIV 감염자 수는 250만~300만 명에 이를 것으로 예상됩니다. HIV 감염과의 싸움이 복잡한 이유는 여러 가지가 있습니다. 첫째, 효과적인 치료법과 구체적인 예방법이 없습니다. 둘째, HIV 감염의 잠복기는 10년을 넘을 수 있습니다. 잠복기는 T 림프구와 염색체에 포함된 DNA 프로바이러스가 활성화되는 시점에 따라 달라집니다. 이 바이러스에 감염된 모든 사람이 에이즈에 걸릴 운명인지, 아니면 질병 없이 바이러스를 장기간 보유할 수 있는지는 아직 불분명합니다(가능성은 낮아 보입니다). 마지막으로, 여러 종류의 인간 면역결핍 바이러스(HIV-1, HIV-2)가 존재하며, 이들 간의 항원적 차이는 교차 면역 형성을 방해합니다. 원숭이 면역결핍 바이러스(SIV)의 발견은 HIV의 기원에 대한 의문을 해소했습니다. SIV는 유전체 구성 면에서 HIV와 유사하지만, 뉴클레오타이드 서열은 상당히 다릅니다. HIV-2는 혈청학적 특성 면에서 HIV-1과 SIV의 중간 위치에 있으며, 뉴클레오타이드 서열 면에서는 SIV에 더 가깝습니다. 이와 관련하여 VM 즈다노프는 HIV-1, HIV-2, SIV 바이러스가 공통 조상에서 유래했다고 주장했습니다. R. 갈로에 따르면, SIV 중 하나가 어떻게든 인체에 침입하여 일련의 돌연변이를 일으켜 HIV-1, HIV-2 및 기타 형태의 바이러스가 출현했을 가능성이 있습니다.
HIV 감염 증상
인간면역결핍바이러스(HIV)는 질병의 발병 기전을 크게 결정하는 몇 가지 특징을 가지고 있습니다. 이 바이러스는 매우 높은 증식률을 보이는데, 이는 조절 요소에 의해 결정됩니다(활성 단계에서 5분 안에 최대 5,000개의 비리온이 합성됩니다). 융합 단백질(gp41)의 존재로 인해, 이 바이러스는 감염된 T-헬퍼와 감염되지 않은 T-헬퍼의 융합을 통해 광범위한 세포융합 구조를 형성하여 대량 사멸을 초래합니다. 대량으로 생성된 gpl20 단백질 분자는 혈액을 자유롭게 순환하며 감염되지 않은 T-헬퍼의 수용체에 결합하여 T-킬러에 의해 인식되고 파괴됩니다. 이 바이러스는 세포 간 통로를 통해 세포에서 세포로 확산될 수 있으며, 이 경우 항체의 접근이 어려워집니다.
HIV 감염의 임상적 기준
성인의 경우, 최소 두 가지 심각한 증상과 최소 한 가지 경미한 증상이 함께 나타나고, 다른 알려진 면역결핍 원인(암, 선천적 면역결핍, 심한 기아 등)이 없을 때 HIV 감염으로 진단됩니다. 심각한 증상은 다음과 같습니다.
- 체중이 10% 이상 감소함
- 장기간 지속되는 발열 상태, 간헐적이거나 지속적임;
- 만성 설사.
경미한 증상: 지속적인 기침, 전신성 피부염, 재발성 대상포진, 구강 및 인두 칸디다증, 만성 단순포진, 전신성 림프절 종대. AIDS 진단은 카포시 육종, 크립토코쿠스 수막염, 폐포자충 폐렴만 있는 경우에 한합니다. 이 질환의 임상 양상은 동반되는 기회감염의 영향을 받습니다.
인간 면역 결핍 바이러스(HIV) 배양 방법
HIV-1과 HIV-2는 백혈병 TCV4 림프구에서 얻은 TCV4 림프구의 한 클론인 H9에서만 배양할 수 있습니다. HIV-1이 잘 증식하는 성상세포의 단층 배양도 이러한 목적으로 사용될 수 있습니다. 동물 중에서 침팬지는 HIV-1에 감염되기 쉽습니다.
외부 환경에서 이 바이러스의 내성은 낮습니다. 햇빛과 자외선에 노출되면 사멸하고, 80°C에서 30분 이내에 사멸하며, 일반적으로 사용되는 소독제로 처리하면 20~30분 이내에 사멸합니다. 바이러스가 포함된 물질을 소독하려면 내성이 가장 강한 미생물에 효과적인 항산균 소독제를 사용해야 합니다.
HIV 감염의 실험실 진단
바이러스 보균 및 HIV 감염 진단의 주요 방법은 효소면역측정법입니다. 그러나 gpl20은 점막 상피세포를 통해 면역글로불린을 운반하는 수용체를 포함한 일부 인간 세포의 수용체와 구조적 및 항원적 유사성을 가지고 있기 때문에, gpl20 항체와 관련된 항체가 체내에 나타날 수 있습니다. 이 경우, ELISA 검사에서 위양성 결과가 나올 수 있습니다. 따라서 양성 반응을 보이는 모든 대상의 혈청은 면역블롯법 또는 웨스턴블롯법을 사용하여 추가 분석을 실시합니다. 이 방법은 전기영동으로 분리한 후, 연구 대상 항체를 확인하고 표지된 항종 항체를 사용하여 검사하는 것을 기반으로 합니다. 바이러스학적 방법은 바이러스 배양의 복잡성으로 인해 거의 사용되지 않습니다. H9 림프구 클론은 진단 검사 시스템의 필수 구성 요소인 바이러스 항원을 얻는 데 사용됩니다. CPR법은 바이러스혈증 초기 단계에서 바이러스를 검출할 수 있도록 합니다.
HIV 감염 치료
역전사효소(리버타제) 또는 바이러스 프로테아제의 활성을 효과적으로 억제하는 약물을 찾거나 합성해야 합니다. 이러한 약물은 프로바이러스 DNA 형성을 막고(또는) 바이러스의 세포 내 증식을 억제합니다. HIV 감염 환자 치료를 위한 현대적 전략은 바이러스 프로테아제(하나의 약물)와 리버타제(두 가지 다른 약물)를 억제하는 약물의 병용(삼중) 요법의 원칙에 기반합니다. 러시아에서는 HIV 감염 환자 치료를 위해 두 가지 국산 약물, 즉 포스파지드와 크릭시반의 병용 요법을 권장합니다. 이 두 약물은 생식 초기 및 후기 단계에서 HIV 증식을 특히 억제하며, 특히 아지도티미딘의 활성을 감소시킵니다.
특정 예방의 문제는 바이러스 특이적 세포독성 림프구에 기반하여 항체를 유의미하게 생성하지 않고도 효과적인 세포 매개 면역을 형성할 수 있는 백신 개발의 필요성입니다. 이러한 면역은 Thl 보조인자에 의해 제공됩니다. 바이러스 중화 항체를 포함한 항체는 HIV 감염 억제에 효과가 없을 뿐만 아니라, 높은 수준에서 세포 매개 면역을 억제할 수 있습니다. 따라서 항 HIV 백신은 우선 두 가지 주요 요건을 충족해야 합니다. a) 절대적으로 안전해야 하고 b) T 세포독성 림프구의 활성을 자극해야 합니다. 사멸된(불활성화된) 바이러스와 높은 방어력을 가진 개별 항원에서 얻은 다양한 백신 변이체의 효능이 연구되고 있습니다. 이러한 항원은 바이러스 자체에서 분리하거나 화학적으로 합성할 수 있습니다. 유전공학적 방법을 기반으로 개발된 백신이 제안되었습니다. 이는 강력한 면역원성을 가진 항원의 합성을 담당하는 HIV 유전자를 보유한 재조합 백시니아 바이러스입니다. HIV 감염의 긴 잠복기와 병원균의 높은 변이성으로 인해 이러한 백신의 효과에 대한 의문은 상당한 시간을 요합니다. HIV에 대한 고효능 백신 개발은 시급한 근본적 문제입니다.


